Plus que des flashs et des flotteurs
Auteurs : Nicole C. Morrow BS, Anthony T. Chung, MD, Michael Wall, MD
Posé le 24 juin 2019
Introduction
Les photopsies (c’est-à-dire les flashs) sont des symptômes de présentation courants dans la clinique ophtalmologique. Bien que la majorité des photopsies soient d’origine rétinienne, la caractérisation de l’apparence, du début et des caractéristiques associées est essentielle pour déterminer la cause de ces descriptions proéminentes mais diverses de “lumières clignotantes”. Le tutoriel suivant aborde les différentes sources de photopsie : traction vitréo-rétinienne, migraines oculaires, dégénérescence maculaire liée à l’âge, diabète, débit sanguin cérébral, hallucinations visuelles, rétinopathie associée au cancer, phénomène entoptique, phosphènes et dysphotopsies associées au cristallin.
Discussion
Décollement du vitré postérieur, déchirures rétiniennes et/ou décollement de la rétine
Un décollement du vitré postérieur (DVP) est une cause fréquente de flotteurs et de photopsies dans la population générale, représentant environ 40% des patients présentant ces symptômes . Les flotteurs (figure 1) sont généralement dus à des cellules ou des débris flottant dans le vitré et projetant des ombres sur la rétine. Les patients décrivent aussi souvent la vision d’un grand flotteur opaque lorsque le vitré se sépare de la tête du nerf optique. A l’examen clinique, cette séparation du vitré du nerf optique circulaire peut être vue comme un anneau de Weiss.
Les photopsies se produisent lorsque le vitré tire sur la rétine. La tension du vitré sur la rétine provoque le déclenchement des cellules rétiniennes et conduit à la perception d’éclairs de lumière. Ces éclairs durent généralement moins d’une seconde et sont décrits comme un éclair ou un flash d’appareil photo dans la périphérie. La forme de l’éclair est généralement curviligne en raison du bord de la traction vitréo-rétinienne. Les photopsies peuvent se produire de manière unilatérale ou bilatérale, mais les flashs bilatéraux se produisent généralement à des moments différents dans chaque œil.
Les déchirures rétiniennes peuvent également provoquer des flotteurs et des flashs lumineux en périphérie . Les déchirures rétiniennes dues à la traction d’un traumatisme ou d’un PVD sont généralement en forme de fer à cheval et, si elles sont suffisamment grandes, le vitré pénètre dans l’espace sous-rétinien, provoquant un décollement de rétine rhégmatogène (RRD) . Une intervention chirurgicale est nécessaire pour les DRR, qui sont associés à une diminution persistante et progressive de la vision que les patients décrivent généralement comme un rideau ou un voile dans leur champ visuel. Il peut être difficile de faire la différence entre une PVD aiguë et des déchirures rétiniennes en se basant uniquement sur l’histoire. Hollands et al. ont constaté que 14% des patients présentant des flotteurs et/ou des flashs et un diagnostic de PVD ont également une déchirure rétinienne ; cependant, s’il n’y a pas de baisse subjective de l’acuité visuelle, ce risque diminue à 8,9%. À l’inverse, si le patient rapporte une baisse subjective de l’acuité visuelle ou si une hémorragie du vitré est observée, le risque de déchirure augmente à 45 % et 62 %, respectivement. Si l’on constate la présence d’un pigment vitreux (c’est-à-dire le signe de Shafer), le risque de déchirure rétinienne peut atteindre 88 %. Chez les patients diagnostiqués avec une PVD sans déchirure rétinienne, 3,4 % ont eu une déchirure rétinienne dans les six semaines suivant leur présentation initiale. Ainsi, tous les patients devraient subir un nouvel examen du fond d’œil dilaté dans les 4 à 6 semaines suivant la présentation initiale.

Figure 1. Illustration des flotteurs typiques d’un décollement postérieur du vitré
Migraine oculaire
La migraine est un syndrome de céphalées récurrentes, fréquemment unilatéral, souvent accompagné d’un prodrome de phénomènes visuels positifs bilatéraux . Une “migraine classique” est décrite par la présence de ce prodrome (c’est-à-dire l’aura) qui dure environ 15 à 30 minutes et qui est suivi d’un mal de tête et de symptômes connexes qui peuvent persister pendant des heures . Bien que le phénomène visuel soit généralement bilatéral, les photopsies peuvent sembler plus importantes dans un œil que dans l’autre. Les symptômes visuels peuvent survenir à chaque migraine ou une seule fois. La migraine et les auras ne sont pas entièrement comprises, et leurs mécanismes sous-jacents font l’objet de nombreux débats. Une théorie dominante veut que les migraines soient causées par des perturbations du flux sanguin cérébral et qu’une vague d’activité neuronale déprimée se déplace lentement dans le cerveau ; ce processus commence généralement dans le lobe occipital et se propage vers l’avant. Une aura migraineuse est probablement le résultat de la vague initiale d’activité neuronale élevée liée à la dépression qui s’étend précédemment, suivie d’une inhibition de l’activité. Les auras peuvent se manifester sous la forme de petites lumières brillantes, de taches aveugles, d’une vision statique ou brumeuse, et/ou de troubles visuels complexes. En général, les auras commencent avant la céphalée sous la forme d’un scotome scintillant en forme de croissant central qui s’étend vers l’extérieur et est entouré de flashs ou de zigzags lumineux. Dans le cas d’une migraine rétinienne, le patient souffre d’une baisse de la vision ou d’une cécité complète dans un œil sans scotome scintillant ; ceci est dû à un vasospasme de la circulation rétinienne ou de l’artère ophtalmique. Dans le cas d’une migraine rétinienne, la vision revient rapidement à la normale. Une forme très rare de migraine est la migraine ophtalmoplégique, qui peut provoquer une paralysie temporaire de l’un des trois nerfs crâniens impliqués dans le mouvement oculaire (CN III, CN IV et CN VI) mais n’est pas associée à des photopsies .


Figure 2. Illustrations de scotomes scintillants typiques des migraines oculaires. Ceux-ci peuvent produire une variété de phénomènes visuels, y compris des zigzags et/ou des images colorées de type “statique”.
Dégénérescence maculaire liée à l’âge
La dégénérescence maculaire liée à l’âge (DMLA) non exsudative (c’est-à-dire sèche) entraîne une perte visuelle centrale bilatérale progressive sans douleur associée. Les patients signalent une diminution de la vision centrale et une métamorphopsie, mais ne présentent généralement pas les photopsies associées à la DMLA sèche. La DMLA exsudative (c’est-à-dire néovasculaire ou humide) est cependant une autre cause fréquente de photopsies et la deuxième cause la plus fréquente dans une série de cas rapportés. Environ 50 % des personnes atteintes de DMLA exsudative déclarent avoir des flashs répétés, situés au centre, qui durent de quelques secondes à quelques minutes. Ces flashs sont généralement décrits comme des scintillements, des pulsations, des lumières scintillantes, des lumières en forme de serpent, des lumières tournoyantes, des roues à picots ou des cercles. Ces lumières sont le plus souvent de couleur blanche, mais certaines personnes ont rapporté avoir vu des lumières bleues, argentées, dorées ou multicolores. La probabilité des photopsies signalées augmente avec la superficie des membranes néovasculaires. Contrairement aux photopsies de la MVP, qui sont stimulées par l’interface rétine-vitréenne interne, les photopsies de la DMLA exsudative résultent de l’accumulation de liquide qui stimule les couches externes de la rétine. Il est parfois difficile de faire la différence entre les deux avant l’examen ; cependant, les flashs centraux sont beaucoup plus fréquents avec la DMLA et les flashs périphériques sont plus fréquents avec la PVD .
Diabète
Le diabète peut provoquer une multitude de changements visuels. La progression de la maladie peut conduire à une rétinopathie diabétique proliférative ou non proliférative. Les patients diabétiques qui contrôlent étroitement leur glycémie peuvent réduire considérablement leur risque de développer une rétinopathie diabétique . Cependant, la majorité des patients développeront une rétinopathie diabétique après 15 ans de maladie. La rétinopathie diabétique non proliférante se caractérise par des microanévrismes, des hémorragies par points, des exsudats durs, des taches de coton et un œdème maculaire. Les patients atteints d’œdème maculaire présentent généralement une baisse de l’acuité visuelle. Cependant, la plupart des patients restent asymptomatiques jusqu’à ce qu’ils atteignent la phase proliférative. La rétinopathie diabétique proliférante se produit lorsque l’ischémie prolongée de la rétine déclenche la formation de nouveaux vaisseaux et de tissu fibreux. La nouvelle croissance fibreuse forme une cicatrice contractée à l’interface vitréo-rétinienne et peut provoquer des photopsies lorsque le tissu se contracte. Cette contraction peut entraîner des décollements de rétine par traction (DTR) avec un risque d’hémorragie du vitré en raison de la fragilité de ces nouveaux vaisseaux. Les patients atteints de DTR peuvent signaler des flotteurs, des photopsies et/ou un rideau sur leur champ visuel qui est similaire aux décollements de rétine rhegmatogènes. Les complications de la rétinopathie diabétique proliférante peuvent entraîner une perte de vision permanente. Dans une petite étude, des patients diabétiques insulinodépendants souffrant d’hypoglycémie ont signalé des photopsies bilatérales qui ont cessé lorsque leur taux de glucose est revenu à la normale. Ils se produisaient dans des environnements clairs ou sombres et étaient décrits comme des scintillements ou des cercles blancs .
Insuffisance basilaire vertébrale
L’insuffisance basilaire vertébrale entraîne une réduction du flux sanguin vers la face postérieure du cerveau et est associée au vieillissement. Cette diminution du flux sanguin provoque une ischémie dans cette zone et entraîne des photopsies bilatérales, qui sont décrites comme des flashs brisés durant quelques secondes à quelques minutes . En outre, l’insuffisance basilaire vertébrale est associée à des vertiges, des étourdissements, une diplopie, une cécité, une faiblesse et une ataxie. Les patients peuvent avoir des flashs lumineux et un brouillard de vision similaires à une migraine visuelle ; cependant, ces symptômes ne se poursuivent pas aussi longtemps et ne se produisent pas avant un mal de tête .
Hallucinations de libération (syndrome de Charles Bonnet)
Les hallucinations de libération se caractérisent par des hallucinations visuelles résultant d’une lésion de la voie visuelle, unilatérale ou bilatérale, chez des individus à la cognition intacte . Les patients décrivent des formes, des grilles, des visages, des personnes et des fleurs multicolores qui durent de quelques secondes à quelques minutes. Le mécanisme sous-jacent est mal compris. La théorie la plus largement acceptée est celle de la privation sensorielle, selon laquelle la perte de stimuli visuels dans le cortex visuel augmente l’excitabilité des neurones. Cette activité neuronale accrue entraîne une mise à feu aléatoire des neurones avec peu ou pas de stimuli, d’où le nom d’hallucinations de libération . Cette hypothèse est étayée par la prévalence élevée chez les personnes dont l’acuité visuelle est faible et après l’application d’un cache-œil postopératoire. La prévalence du syndrome de Charles Bonnet augmente chez les individus ayant une moins bonne acuité visuelle bilatérale .
Rétinopathie associée au cancer
La rétinopathie associée au cancer est une maladie auto-immune rare où l’organisme développe des auto-anticorps contre les antigènes rétiniens . La récupérine et l’a-énolase sont les antigènes rétiniens les plus courants pour lesquels des auto-anticorps se développent . Ces anticorps se développent généralement en présence d’une maladie maligne, le plus souvent un cancer du poumon à petites cellules. Les patients qui développent cette maladie présentent souvent une baisse de l’acuité visuelle secondaire à un dysfonctionnement des photorécepteurs. Les individus peuvent présenter une photosensibilité, un éblouissement accru après une exposition à la lumière, une diminution de la vision des couleurs et/ou des scotomes centraux et des scotomes arqués en forme de saucisse (Bjerrum) dus à un dysfonctionnement des cônes. L’héméralopie, les scotomes annulaires périphériques ou une baisse significative de la vision périphérique peuvent être observés en cas de dysfonctionnement des bâtonnets. Des photopsies sont également observées dans 7 à 15 % des cas de rétinopathie associée au cancer. Elles sont décrites comme des lumières vacillantes ou scintillantes et on pense qu’elles sont causées par la dégénérescence rétinienne. Une étude a révélé que les symptômes visuels peuvent précéder un diagnostic de cancer .
Phénomène entoptique
Lorsque les individus perçoivent une image qui provient de leurs propres yeux, cela s’appelle une image entoptique (figure 3). Ce phénomène peut survenir lorsqu’on éclaire une lampe-stylo en contact avec les paupières fermées d’un individu puis qu’on déplace la lampe-stylo . Les images qui apparaissent dans ce cas sont décrites comme un motif de lignes ramifiées dû à l’ombre projetée par les vaisseaux rétiniens sur d’autres zones de la rétine. Parfois, l’image peut clignoter et pulser avec les battements du cœur et rester pendant quelques secondes alors que la source lumineuse continue de bouger. Dans le passé, ce phénomène était utilisé comme un test alternatif de l’acuité visuelle. Si un individu était capable de voir le motif de ramification dans un œil mais pas dans l’autre, l’œil qui ne voyait pas l’image était déterminé comme ayant une fonction maculaire plus faible .
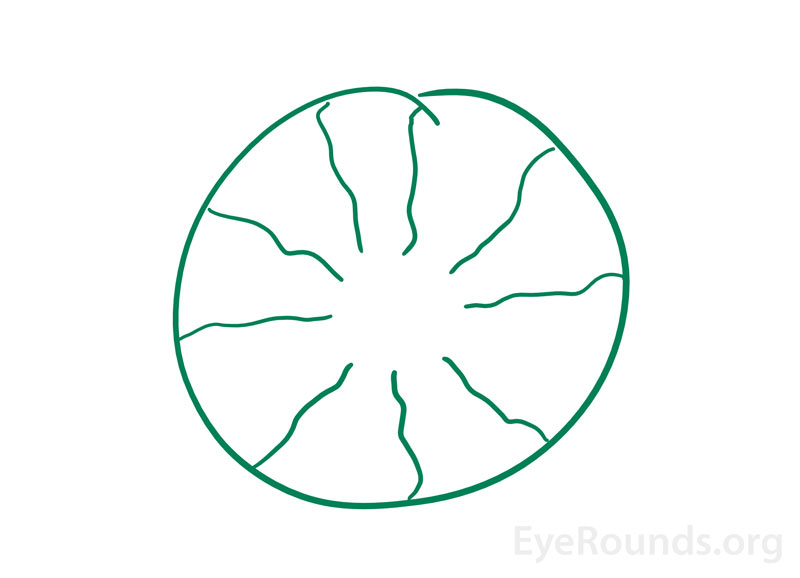
Figure 3. Illustration d’un phénomène entoptique fournie par un patient très avisé de la clinique de neuro-ophtalmologie. Il a signalé l’apparition d’une “image verte comme un beignet avec des lignes radiales ondulées” au réveil depuis 6 à 12 mois. Les examens oculaires précédents, effectués localement, étaient sans particularité. On a pensé que cela était dû à l’image rémanente de sa zone fovéale avasculaire (trou dans le beignet) et des vaisseaux sanguins radiaux.
Phosphènes
Les phosphènes sont une photopsie positive qui sont vus sans source de lumière . Ils sont décrits comme des flashs de lumière, des barres/points de lumière, ou des taches colorées. Ils peuvent être provoqués par le frottement des yeux, la toux, un traumatisme crânien ou d’autres causes pathologiques. On pense que la production de phosphènes par ces mécanismes est due à l’excitation des photorécepteurs de la rétine par une pression mécanique. Les autres mécanismes sous-jacents varient en fonction de la pathologie observée dans l’œil. La traction rétinienne, les décollements de la rétine, la rétinopathie associée au cancer et l’hallucination de libération sont tous des causes pathologiques de phosphènes et se produisent comme indiqué ci-dessus. Les phosphènes sont également expérimentés lors d’intoxications par des substances ou d’irradiation de l’œil .
Dysphotopsies positives et négatives
Les dysphotopsies positives et négatives sont des occurrences courantes après une extraction de cataracte avec placement d’une lentille intraoculaire. La description typique donnée des dysphotopsies positives sont des éclairs de lumière, des éblouissements ou des halos présents en périphérie . Ces phénomènes se produisent lorsque les yeux sont ouverts et varient en fonction de la luminosité, le plus souvent lorsqu’une personne entre dans une pièce éclairée et que ses pupilles sont dilatées. Ils s’opposent aux photopsies dues à une traction du vitré, qui sont généralement provoquées dans l’obscurité et déclenchées par des mouvements de l’œil. Contrairement aux décollements de la rétine, les dysphotopsies positives ne sont pas persistantes et n’augmentent pas en taille. Le mécanisme sous-jacent des dysphotopsies positives est le résultat de réflexions aberrantes de la lumière sur le bord de la lentille intraoculaire .
En revanche, les dysphotopsies négatives sont généralement décrites comme des arcs, ou des ombres en forme de croissant, dans la périphérie . Le mécanisme sous-jacent des dysphotopsies négatives est dû à la fraction de la lumière qui se réfléchit loin de l’œil, provoquant une petite zone dans laquelle la lumière n’atteint pas la rétine . Les dysphotopsies négatives disparaissent généralement lorsque le patient est dilaté. Les dysphotopsies positives et négatives sont plus fréquentes avec les petites LIO à bords tranchants. Les LIO multifocales sont également associées à une augmentation des éblouissements et des photopsies par rapport aux LIO monofocales. Ces symptômes sont les plus fréquents au début de la période postopératoire, mais ils disparaissent généralement au fur et à mesure que la capsule se fibrose. Bien que relativement peu fréquents, certains patients peuvent les trouver suffisamment distrayants pour nécessiter un repositionnement ou un placement secondaire de la lentille intraoculaire.
- Brown GC, Brown MM, Fischer DH. Photopsies : Une clé pour le diagnostic. Ophthalmology 2015;122(10):2084-2094. https://PubMed.gov/26249730. DOI : 10.1016/j.ophtha.2015.06.025
- Sharma P, Sridhar J, Mehta S. Flashs et flotteurs. Prim Care 2015;42(3):425-435. https://PubMed.gov/26319347. DOI : 10.1016/j.pop.2015.05.011
- Horton JC. Troubles de l’œil. In : Kasper D, Fauci A, Hauser S, Longo D, Jameson JL, Loscalzo J, éditeurs. Harrison’s Principles of Internal Medicine, 19e. New York, NY : McGraw-Hill Education ; 2014.
- Hollands H, Johnson D, Brox AC, Almeida D, Simel DL, Sharma S. Acute-onset floaters and flashes : is this patient at risk for retinal detachment ? Jama 2009;302(20):2243-2249. https://PubMed.gov/19934426. DOI : 10.1001/jama.2009.1714
- Aminoff MJ, Greenberg DA, Simon RP. Maux de tête & ; douleur faciale. Neurologie clinique, 9e. New York, NY : McGraw-Hill Education ; 2015.
- Vincent MB. La vision et la migraine. Headache 2015;55(4):595-599. https://PubMed.gov/25758366. DOI : 10.1111/head.12531
- Marzoli SB, Criscuoli A. Le rôle du système visuel dans la migraine. Neurol Sci 2017;38(Suppl 1):99-102. https://PubMed.gov/28527076. DOI : 10.1007/s10072-017-2890-0
- Pelletier AL, Rojas-Roldan L, Coffin J. Perte de vision chez les personnes âgées. Am Fam Physician 2016;94(3):219-226. https://PubMed.gov/27479624
- Masharani U. Diabète sucré & ; Hypoglycémie. In : Papadakis MA, McPhee SJ, Rabow MW, éditeurs. Diagnostic médical actuel & ; traitement 2018. New York, NY : McGraw-Hill Education ; 2018.
- Zhao Q, Zhou F, Zhang Y, Zhou X, Ying C. Niveaux de variabilité du glucose plasmatique à jeun et risque de résultats indésirables chez les patients atteints de diabète de type 2 : Une revue systématique et une méta-analyse. Diabetes Res Clin Pract 2018;10.1016/j.diabres.2018.12.010. https://PubMed.gov/30583033. DOI : 10.1016/j.diabres.2018.12.010
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. L’étude épidémiologique du Wisconsin sur la rétinopathie diabétique. II. Prévalence et risque de rétinopathie diabétique lorsque l’âge au moment du diagnostic est inférieur à 30 ans. Arch Ophthalmol 1984;102(4):520-526. https://PubMed.gov/6367724
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. L’étude épidémiologique du Wisconsin sur la rétinopathie diabétique. III. Prévalence et risque de rétinopathie diabétique lorsque l’âge au moment du diagnostic est de 30 ans ou plus. Arch Ophthalmol 1984;102(4):527-532. https://PubMed.gov/6367725
- Ophtalmologie de base : éléments essentiels pour les étudiants en médecine. 10th ed : American Academy of Ophthalmology, 2016.
- Lima Neto AC, Bittar R, Gattas GS, Bor-Seng-Shu E, Oliveira ML, Monsanto RDC, Bittar LF. Physiopathologie et diagnostic de l’insuffisance vertébrobasilaire : A Review of the Literature. Int Arch Otorhinolaryngol 2017;21(3):302-307. https://PubMed.gov/28680502. DOI : 10.1055/s-0036-1593448
- Pang L. Hallucinations expérimentées par les malvoyants : Charles Bonnet Syndrome. Optom Vis Sci 2016;93(12):1466-1478. https://PubMed.gov/27529611. DOI : 10.1097/opx.0000000000000959
- Vahdani K, Poon JS, Antoniou E, Giasin O, Makrygiannis G. Syndrome de Charles Bonnet après une chirurgie de reconstruction des paupières. Ophthalmic Plast Reconstr Surg 2017;33(3):229-230. https://PubMed.gov/28475529. DOI : 10.1097/iop.0000000000000892
- Beaulieu RA, Tamboli DA, Armstrong BK, Hogan RN, Mancini R. Reversible Charles Bonnet Syndrome After Oculoplastic Procedures. J Neuroophthalmol 2018;38(3):334-336. https://PubMed.gov/27984353. DOI : 10.1097/wno.0000000000000477
- Moyer K, DeWilde A, Law C. Œdème maculaire cystoïde de la rétinopathie associée au cancer. Optom Vis Sci 2014;91(4 Suppl 1):S66-70. https://PubMed.gov/24531653. DOI : 10.1097/opx.0000000000000184
- Grange L, Dalal M, Nussenblatt RB, Sen HN. La rétinopathie auto-immune. Am J Ophthalmol 2014;157(2):266-272.e261. https://PubMed.gov/24315290. DOI : 10.1016/j.ajo.2013.09.019
- Grewal DS, Fishman GA, Jampol LM. Rétinopathie auto-immune et anticorps anti-rétiniens : une revue. Retina 2014;34(5):827-845. https://PubMed.gov/24646664. DOI : 10.1097/iae.0000000000000119
- Adamus G. Les cibles des auto-anticorps et leur relation cancéreuse dans la pathogénicité de la rétinopathie paranéoplasique. Autoimmun Rev 2009;8(5):410-414. https://PubMed.gov/19168157. DOI : 10.1016/j.autrev.2009.01.002
- Chang DF. Chapitre 2. Examen ophtalmologique. Dans : Riordan-Eva P, Cunningham ET, éditeurs. Vaughan & ; Asbury’s General Ophthalmology, 18e. New York, NY : The McGraw-Hill Companies ; 2011.
- Coppola D, Purves D. La disparition extraordinairement rapide des images entoptiques. Proc Natl Acad Sci U S A 1996;93(15):8001-8004. https://PubMed.gov/8755592
- Mark HH. La vision entoptique des vaisseaux rétiniens. Acta Ophthalmol 2014;92(3):e237-240. https://PubMed.gov/23890291. DOI : 10.1111/aos.12192
- Ropper AH, Samuels MA, Klein JP. Chapitre 13. Perturbations de la vision. Principes de neurologie de Adams et Victor, 10e. New York, NY : The McGraw-Hill Companies ; 2014.
- Salari V, Scholkmann F, Vimal RLP, Csaszar N, Aslani M, Bokkon I. Phosphènes, bruit sombre discret rétinien, images postérieures négatives et projections rétinogéniques : Un nouveau cadre explicatif basé sur la luminescence oculaire endogène. Prog Retin Eye Res 2017;60:101-119. https://PubMed.gov/28729002. DOI : 10.1016/j.preteyeres.2017.07.001
- Mathis T, Vignot S, Leal C, Caujolle JP, Maschi C, Mauget-Faysse M, Kodjikian L, Baillif S, Herault J, Thariat J. Mécanismes des phosphènes chez les patients irradiés. Oncotarget 2017;8(38):64579-64590. https://PubMed.gov/28969095. DOI : 10.18632/oncotarget.18719
- Bournas P, Drazinos S, Kanellas D, Arvanitis M, Vaikoussis E. Dysphotopsie après chirurgie de la cataracte : comparaison de quatre lentilles intraoculaires différentes. Ophthalmologica 2007;221(6):378-383. https://PubMed.gov/17947823. DOI : 10.1159/000107496
- Davison JA. Dysphotopsie positive et négative chez les patients porteurs de lentilles intraoculaires acryliques. J Cataract Refract Surg 2000;26(9):1346-1355. https://PubMed.gov/11020620
- Hu J, Sella R, Afshari NA. La dysphotopsie : un phénomène optique aux multiples facettes. Curr Opin Ophthalmol 2018;29(1):61-68. https://PubMed.gov/29084005. DOI : 10.1097/icu.0000000000000447
- Wang SY, Stem MS, Oren G, Shtein R, Lichter PR. Résultats centrés sur le patient et qualité visuelle de la chirurgie de la cataracte premium : une revue systématique. Eur J Ophthalmol 2017;27(4):387-401. https://PubMed.gov/28574135. DOI : 10.5301/ejo.5000978
Format de citation suggéré
Morrow N, Chung AT, Wall M. Photopsies. EyeRounds.org. 24 juin 2019 ; Disponible à partir de https://EyeRounds.org/tutorials/photopsias/index.htm