フラッシュや浮遊物だけではない
著者 Nicole C. Morrow BS, Anthony T. Chung, MD, Michael Wall, MD
Posted June 24, 2019
Introduction
Photopsias(=flash)は眼科クリニックでよく見られる提示症状である。 光視症の大部分は網膜由来であるが,その外観,発症,関連する特徴を明らかにすることは,これらの顕著かつ多様な「閃光」の記述の原因を特定する上で極めて重要である。 網膜硝子体牽引、眼精疲労、加齢黄斑変性、糖尿病、脳血流、幻覚、癌性網膜症、内視鏡現象、フォスフェーン、水晶体関連視力障害など、さまざまな光視症の原因について解説しています。
考察
後部硝子体剥離、網膜裂孔、網膜剥離
後部硝子体剥離(PVD)は、一般集団における浮遊物や視力の共通の原因であり、これらの症状を呈する患者の約40%を占めている。 浮遊物(図1)は、硝子体中に浮遊する細胞やゴミが網膜に影を落とすことが原因です。 また、患者はしばしば、硝子体が視神経乳頭の周囲から剥離する際に、大きな不透明な浮遊物を見ることを説明します。 臨床検査では、この円形の視神経からの硝子体分離はWeiss ringとして見ることができます
光視症は、硝子体が網膜を引っ張ることで発生します。 網膜にかかる硝子体の張力によって網膜細胞が発火し、閃光を知覚するようになります。 この閃光は通常1秒以内で、周辺部で稲妻やカメラのフラッシュのように表現されます。 稲妻の形状は、網膜硝子体牽引のエッジにより、通常、曲線的です。 光視症は片側または両側に発生することがありますが、両側の光視症は通常、それぞれの眼で異なる時間に発生します。
網膜裂孔はまた、周辺部に浮遊物や閃光を引き起こすことがあります。 外傷やPVDの牽引による網膜裂孔は一般的に馬蹄形であり、十分に大きい場合は硝子体が網膜下腔に入り込み、裂孔原性網膜剥離(RRD)を引き起こします。 RRDは、持続的かつ進行性の視力低下を伴い、患者は通常、視野にカーテンやベールがかかったように見えると表現しています。 急性のPVDと網膜裂孔の鑑別は病歴だけでは難しい場合があります。 Hollandsらの報告によると、浮動性または閃光を呈しPVDと診断された患者の14%が網膜裂孔を有しています。しかし、自覚的な視力低下がない場合、このリスクは8.9%に減少します。 逆に、患者が主観的な視力低下を訴えたり、硝子体出血を認めたりした場合、裂孔のリスクはそれぞれ45%、62%に上昇します。 また、硝子体色素(シェーファー徴候)が認められる場合、網膜裂孔のリスクは88%にも上ります。 網膜裂孔を伴わないPVDと診断された患者のうち、3.4%は初診から6週間以内に網膜裂孔を発症していました。 したがって、すべての患者は初診から4~6週間以内に拡張眼底検査を再度受ける必要があります。

図1. 後部硝子体剥離に典型的な浮遊物のイラスト
Ocular Migraine
Migraine is a recurrent, frequently unilateral, headache syndrome often with the prodrome of bilateral positive visual phenomena … 両側性の陽性視覚現象の前駆症状を伴うことが多い。 古典的な片頭痛」は、この前兆(すなわち前兆)が約15~30分続き、その後、数時間持続する頭痛と関連する症状があることで説明される。 視覚現象は通常両側性に起こるが、羞明は片方の眼が他方より大きく見えることがある。 視覚症状は、片頭痛が起こるたびに起こることもあれば、一度だけ起こることもあります。 片頭痛とオーラは完全に解明されておらず、その根本的なメカニズムについては多くの議論があります。 片頭痛は、脳血流の障害によって引き起こされ、神経細胞の活動を低下させる波が脳をゆっくりと移動し、この過程は通常後頭葉から始まり前方に広がっていくとする説が有力である。 片頭痛の前兆は、先に述べた神経活動の抑制に関連した最初の高波の結果である可能性が高い。 前兆は、小さな明るい光、盲点、静的/霧の視界、および/または複雑な視覚障害として現れることがある。 一般に、オーラは頭痛の前に、外側に広がり、閃光またはジグザグの光に囲まれた中央の三日月形のシンチレーション光塊として始まる。 網膜片頭痛では、網膜循環や眼動脈の血管攣縮により、シンチレーション光腫を伴わない片眼の視力低下や完全失明が起こります。 網膜片頭痛の視力はすぐに元に戻る。 片頭痛の非常に珍しい型は、眼球運動に関与する3つの脳神経(CN III、CN IV、CN VI)のいずれかが一時的に麻痺する眼筋麻痺片頭痛で、羞明は伴わない。


図2. 眼部片頭痛に典型的なシンチレーション性スコトーマの図解。 これらは、ジグザグおよび/またはカラフルな「静的な」画像を含む様々な視覚現象を生じさせることができる。
加齢黄斑変性症
非滲出性(すなわち、ドライ)加齢黄斑変性(AMD)は、関連する痛みなしに、徐々に両側中心の視覚損失を引き起こします。 患者は中心視力の低下と変視症を訴えるが、通常、ドライ型AMDに伴う羞明はない。 しかし、滲出型(すなわち、新生血管または湿性)AMDは、光視症のもう一つの一般的な原因であり、ある報告されたケースシリーズでは2番目に多い原因であった。 滲出型AMD患者の約50%が、中心部に数秒から数分間持続する閃光を繰り返し経験すると報告している。 これらの閃光は、通常、明滅、脈動、きらめく光、蛇のような光、回転する光、風車、または円形と表現される。 これらの光は白色であることが最も一般的ですが、青色、銀色、金色、または複数の色の光を見たという報告もあります。 新生血管膜の面積が大きくなるにつれて、光視症が報告される可能性が高くなります。 網膜-硝子体内部の刺激によるPVDの光視症とは異なり、滲出性AMDの光視症は網膜外層に蓄積した液体が刺激となって起こります。 しかし、中心部の閃光はAMDで、周辺部の閃光はPVDでより一般的です。
糖尿病
糖尿病は、多くの視覚変化を引き起こす可能性があります。 病気の進行は、増殖性または非増殖性の糖尿病性網膜症につながる可能性があります。 血糖値をしっかり管理している糖尿病患者は、糖尿病性網膜症を発症するリスクを大幅に減らすことができます。 しかし、糖尿病患者の大半は、発症から15年後に糖尿病性網膜症を発症します。 非増殖型糖尿病網膜症は、微小動脈瘤、点状出血、硬い滲出液、綿毛状斑点、黄斑浮腫が特徴です。 黄斑浮腫のある患者は、一般的に視力の低下を呈します。 しかし、ほとんどの患者は増殖期に入るまで無症状のままである。 増殖糖尿病網膜症は、網膜の虚血が長引くと、新しい血管や線維組織が形成されることで起こります。 線維性組織の新生により、硝子体網膜界面に収縮した瘢痕が形成され、組織の収縮に伴って光視症を引き起こすことがあります。 この収縮は牽引性網膜剥離(TRD)の原因となり、新生血管が脆弱なために硝子体出血を引き起こす可能性があります。 TRDの患者は、浮遊物、羞明、および/または、裂孔原性網膜剥離に類似した視野上のカーテンを報告することがあります。 増殖糖尿病網膜症の合併症は、永久的な視力低下をもたらす可能性があります。 ある小規模な研究では、インスリン依存型糖尿病患者の低血糖により、両側の光視症が報告され、グルコースが正常レベルに戻ると光視症が停止した。 この光視症は明るい場所でも暗い場所でも起こり、白いチラツキや円形と表現された。
椎骨脳底部閉鎖不全
椎骨脳底部閉鎖不全は、脳の後面への血流を減少させ、老化と関連するものである。 この血流低下はこの部分の虚血を引き起こし、数秒から数分間続く壊れた閃光と表現される両側の光視症につながる。 さらに、椎骨脳底部機能不全は、めまい、めまい、複視、失明、脱力、運動失調をともないます。 また、視覚性片頭痛と同様の閃光や視界の曇りが生じることがあるが、これらの症状はそれほど長く続かず、頭痛の前には生じない。
放出性幻覚(シャルル・ボネ症候群)
放出性幻覚は、認知能力に問題のない個人の片側または両側の視覚経路への損傷から生じる幻覚として特徴づけられる。 患者は数秒から数分間続く多色の形、格子、顔、人、花などを見ると説明する。 そのメカニズムはよく分かっていない。 最も広く受け入れられているのは感覚遮断説で、視覚皮質への視覚刺激の喪失がニューロンの興奮性を高めるとするものである。 この神経細胞活動の増加により、刺激がほとんどない状態で神経細胞がランダムに発火するため、解放幻覚と呼ばれるようになった . このことは、視力の低い人や術後のアイパッチ後に多く見られることからも裏付けられます。
がん関連網膜症
がん関連網膜症は、体が網膜抗原に対する自己抗体を発症するまれな自己免疫疾患である 。 自己抗体ができる網膜抗原としては、リコベリンとa-エノラーゼが最も一般的です。 これらの抗体は、通常、悪性腫瘍(特に小細胞肺癌)の存在下で発症します。 この疾患を発症した患者は、視細胞機能障害による二次的な視力低下を示すことが多い。 光線過敏症、光照射後のまぶしさの増加、色覚の低下、錐体機能不全による中心性暗点およびソーセージ状の弧状暗点(Bjerrum)などを経験することがあります。 杆体機能障害では、夜盲症、周辺環状スコトーマ、または周辺視力の著しい低下が見られることがあります。 また、がん関連網膜症では約7~15%の確率で光視症が認められます。 これはチカチカする光と表現され、網膜の変性が原因であると考えられています。 ある研究では、視覚的な症状が癌の診断につながる可能性があることがわかった。 この現象は、閉じたまぶたにペンライトを当てて、そのペンライトを動かすことで発生することがある。 網膜の血管の影が網膜の他の部分に映り込むため、枝分かれした線状の像が見えると言われている。 また、心拍に合わせて点滅したり脈打ったりすることもあり、光源を動かし続けると数秒間その状態が続きます。 かつて、この現象は視力の代替テストとして用いられました。 片方の目では枝分かれしたパターンが見えるのに、もう片方の目では見えない場合、画像が見えない方の目は黄斑機能が低下していると判断されました。
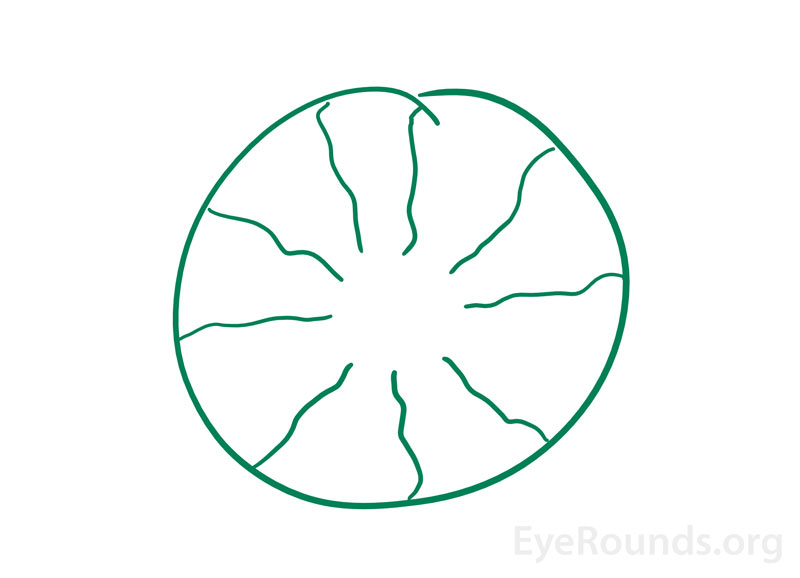
Fig. 神経眼科クリニックの非常に聡明な患者から提供された entoptic 現象のイラスト。 彼は過去6-12ヶ月間、起床時に「放射状のスクイグリー線があるドーナツのような緑色の像」の発症を報告した。 これまでの眼科検査では、局所的には異常はなかった。 これは、彼の無血管窩洞(ドーナツの穴)と橈骨血管の残像によるものと思われた。
Phosphenes
Phosphenes は光源なしで見られる陽性羞明である. 閃光、光の棒/点、または色のついた斑点として表現される。 目をこする、咳をする、頭に外傷を負う、あるいは他の病的な原因によって誘発されることがある。 これらのメカニズムによるフォスフェンの生成は、機械的な圧力によって網膜の光受容体が励起されるためと考えられている。 その他の基本的なメカニズムは、眼球内の病理によって異なる。 網膜牽引、網膜剥離、癌性網膜症、解放幻覚は、いずれも病的なフォスフェンの原因であり、上述したように発生する。
Positive and negative dysphotopsias 眼内レンズの装着を伴う白内障摘出後によく発生する現象である。 陽性視力異常の典型的な症状は、閃光、まぶしさ、または周辺部に存在するハローである。 これらは目を開けているときに起こり、光の状況によって変化します。最も一般的なのは、暗闇から明るい部屋に入るときに、瞳孔が拡張しているときに起こります。 これらは硝子体牽引による光視症とは対照的で、通常、暗闇で誘発され、眼球の動きによって誘発される。 網膜剥離とは異なり、陽性光視力異常は持続せず、サイズも増加しません。
一方、陰性光視症は、一般的に円弧状または三日月状の周辺部の影として表現されます。 負の視力異常の根本的なメカニズムは、眼球から反射する光の割合によって、光が網膜に到達しない小さな領域が発生することに起因する。 負の視力障害は、患者が拡張されたときに一般的に解消される。 正と負の両方の視力異常は、小さな鋭角の眼内レンズでより一般的である。 多焦点眼内レンズは、単焦点眼内レンズと比較して、まぶしさや光視症の増加にも関連します。 これらの症状は術後初期に最も一般的であるが、カプセルが線維化するにつれて一般的に治まる。 比較的まれではあるが、患者によっては、眼内レンズの再置換や二次装着を必要とするほど、これらの症状に気を取られることもある
- Brown GC, Brown MM, Fischer DH. 光視症。 診断のポイント Ophthalmology 2015;122(10):2084-2094. https://PubMed.gov/26249730. DOI: 10.1016/j.ophtha.2015.06.025
- Sharma P, Sridhar J, Mehta S. Flashes and Floaters.日本眼科医会(東京)編. プリムケア2015;42(3):425-435. https://PubMed.gov/26319347. DOI: 10.1016/j.pop.2015.05.011
- Horton JC. 眼の障害. にて。 Kasper D, Fauci A, Hauser S, Longo D, Jameson JL, Loscalzo J, editors.(カスパーD、ファウチA、ハウザーS、ロンゴD、ジェイムソンJL、ロスカルゾJ、編)。 ハリソンの内科の原則、19e。 ニューヨーク、NY。 McGraw-Hill Education; 2014.
- Hollands H, Johnson D, Brox AC, Almeida D, Simel DL, Sharma S. Acute-onset floatingers and flashes: Is this patient at risk for retinal detachment? Jama 2009;302(20):2243-2249. https://PubMed.gov/19934426. DOI: 10.1001/jama.2009.1714
- Aminoff MJ, Greenberg DA, Simon RP. 頭痛&顔面痛。 Clinical Neurology, 9e. ニューヨーク,NY. McGraw-Hill Education; 2015.
- Vincent MB. 視覚と片頭痛. Headache 2015;55(4):595-599. https://PubMed.gov/25758366. DOI: 10.1111/head.12531
- Marzoli SB, Criscuoli A. The role of visual system in migraine.片頭痛における視覚系の役割.DOI: 10.1111/head.12531
- Pelletier AL, Rojas-Roldan L, Coffin J. Vision Loss in Older Adults.「高齢者の視力低下」. Am Fam Physician 2016;94(3):219-226. https://PubMed.gov/27479624
- Masharani U. 糖尿病&低血糖症。 で。 Papadakis MA, McPhee SJ, Rabow MW, editors. Current Medical Diagnosis & Treatment 2018(カレント・メディカル・ダイアグノシス& トリートメントの2018年版)。 New York, NY: McGraw-Hill Education; 2018.
- Zhao Q, Zhou F, Zhang Y, Zhou X, Ying C. Fasting Plasma Glucose Variability Levels and Risk of Adverse Outcomes Among Patients with Type 2 Diabetes: システマティックレビューとメタアナリシス。 Diabetes Res Clin Pract 2018;10.1016/j.diabres.2018.12.010. https://PubMed.gov/30583033. DOI: 10.1016/j.diabres.2018.12.010
- Klein R、Klein BE、Moss SE、Davis MD、DeMets DL.。 糖尿病性網膜症に関するウィスコンシン疫学研究。 II. 診断時の年齢が30歳未満の場合の糖尿病性網膜症の有病率およびリスク。 Arch Ophthalmol 1984;102(4):520-526。 https://PubMed.gov/6367724
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. 糖尿病性網膜症に関するウィスコンシン疫学調査。 III. 診断時年齢が30歳以上の場合の糖尿病性網膜症の有病率およびリスク。 Arch Ophthalmol 1984;102(4):527-532. https://PubMed.gov/6367725
- Basic ophthalmology: essentials for medical students. 第10版: American Academy of Ophthalmology, 2016.
- Lima Neto AC, Bittar R, Gattas GS, Bor-Seng-Shu E, Oliveira ML, Monsanto RDC, Bittar LF. 椎骨脳底動脈不全の病態と診断. 文献のレビュー。 Int Arch Otorhinolaryngol 2017;21(3):302-307. https://PubMed.gov/28680502. DOI: 10.1055/s-0036-1593448
- Pang L. Visually Impaired Experienced Hallucinations(視覚障害者が経験する幻覚。 シャルル・ボネ・シンドローム。 Optom Vis Sci 2016;93(12):1466-1478. https://PubMed.gov/27529611. DOI: 10.1097/opx.0000000000000959
- Vahdani K, Poon JS, Antoniou E, Giasin O, Makrygiannis G. Charles Bonnet Syndrome Following Eyelid Reconstruction Surgery.(瞼整形手術後のシャルル・ボネ症候群)。 Ophthalmic Plast Reconstr Surg 2017;33(3):229-230. https://PubMed.gov/28475529. DOI: 10.1097/iop.0000000000000892
- Beaulieu RA, Tamboli DA, Armstrong BK, Hogan RN, Mancini R. Reversible Charles Bonnet Syndrome After Oculoplastic Procedures.眼科整形手術後のシャルルボネ症候群. J Neuroophthalmol 2018;38(3):334-336を参照。 https://PubMed.gov/27984353. DOI: 10.1097/wno.0000000000000477
- Moyer K, DeWilde A, Law C. Cystoid macular edema from cancer-associated retinopathy(がん関連網膜症によるシストイド黄斑浮腫)。 Optom Vis Sci 2014;91(4 Suppl 1):S66-70. https://PubMed.gov/24531653. DOI: 10.1097/opx.000000000184
- Grange L、Dalal M、Nussenblatt RB、Sen HN. 自己免疫性網膜症。 Am J Ophthalmol 2014;157(2):266-272.e261. https://PubMed.gov/24315290. DOI: 10.1016/j.ajo.2013.09.019
- Grewal DS, Fishman GA, Jampol LM. 自己免疫性網膜症と抗網膜抗体:レビュー。 Retina 2014;34(5):827-845. https://PubMed.gov/24646664. DOI: 10.1097/iae.000000000119
- Adamus G. Autoantibody targets and their cancer relationship in the pathogenicity of paraneoplastic retinopathy.自己免疫網膜症における自己抗体のターゲットとそのがんとの関係.DOI: 10.1097/iae.000000000119
- Chang DF. 第2章. 眼科検査。 で。 Riordan-Eva P, Cunningham ET, editors. Vaughan & Asbury’s General Ophthalmology, 18e.に掲載されています。 New York, NY: 5191>
- Coppola D, Purves D. The extraordinarily rapid disappearance of entoptic images.(コッポラD、パーブスD.特別に速い眼球像の消失). を参照してください。 https://PubMed.gov/8755592
- Mark HH. 網膜血管のエントロプティックビュー. Acta Ophthalmol 2014;92(3):e237-240. https://PubMed.gov/23890291. DOI: 10.1111/aos.12192
- Ropper AH, Samuels MA, Klein JP. 第13章. 視覚の障害. アダムズとビクターの神経学の原則、10e。 New York, NY: The McGraw-Hill Companies; 2014.
- Salari V, Scholkmann F, Vimal RLP, Csaszar N, Aslani M, Bokkon I. Phosphenes, retinal discrete dark noise, negative afterimages and retinogeniculate projections.視力障害: 内因性眼球発光に基づく新しい説明の枠組み。 Prog Retin Eye Res 2017;60:101-119。 https://PubMed.gov/28729002. DOI: 10.1016/j.preteyeres.2017.07.001
- Mathis T, Vignot S, Leal C, Caujolle JP, Maschi C, Mauget-Faysse M, Kodjikian L, Baillif S, Herault J, Thariat J. irradiated patientsにおけるphosphenesの機序.Machines of phosphenes in a irradiated patients. Oncotarget 2017;8(38):64579-64590. https://PubMed.gov/28969095. DOI: 10.18632/oncotarget.18719
- Bournas P, Drazinos S, Kanellas D, Arvanitis M, Vaikoussis E. Dysphotopsia after Cataract surgery: comparison of four different intraocular lenses.白人手術後の眼精疲労。 Ophthalmologica 2007;221(6):378-383. https://PubMed.gov/17947823. DOI: 10.1159/000107496
- Davison JA. アクリル製眼内レンズを装着した患者における陽性および陰性視力障害。 J Cataract Refract Surg 2000;26(9):1346-1355. https://PubMed.gov/11020620
- Hu J, Sella R, Afshari NA. 視力障害:多面的な視力現象。 Curr Opin Ophthalmol 2018;29(1):61-68. https://PubMed.gov/29084005. DOI: 10.1097/icu.0000000000000447
- Wang SY, Stem MS, Oren G, Shtein R, Lichter PR.(以下、Wang)。 プレミアム白内障手術の患者中心および視覚的品質アウトカム:系統的レビュー。 Eur J Ophthalmol 2017;27(4):387-401. https://PubMed.gov/28574135. DOI: 10.5301/ejo.5000978
Marzoli AB. Neurol Sci 2017;38(Suppl 1):99-102. https://PubMed.gov/28527076. DOI: 10.1007/s10072-017-2890-0
. Autoimmun Rev 2009;8(5):410-414. https://PubMed.gov/19168157. DOI: 10.1016/j.autrev.2009.01.002
Suggested Citation Format
Morrow N, Chung AT, Wall M. Photopsias.を引用しました。 アイラウンド.jp 2019年6月24日; https://EyeRounds.org/tutorials/photopsias/index.htm