Co to jest Cur
Cur (wymawiany jako KYOOR-ee-em) jest radioaktywnym metalem należącym do rodziny metali aktynowców i oznaczany symbolem chemicznym Cm .

Symbol Curu
Izotopy Curu
Ma 15 izotopów, z których najbardziej stabilny jest Cur-247 o okresie połowicznego zaniku wynoszącym około 15 600 000 lat, który ulega rozpadowi alfa tworząc pluton-243 .
Historia
Pochodzenie nazwy: Nazwę zawdzięcza znanym naukowcom, Pierre’owi Curie i Marii Curie, odkrywcom radu.
Kto go odkrył: Pierwiastek został zsyntetyzowany przez zespół badawczy Glenna Seaborga, Alberta Ghiorso i Ralpha Jamesa .

Cur
Gdzie odkryto Cur
W 1944 roku Seaborg, Ghiorso i James zbombardowali pluton-239 cząstkami alfa w cyklotronie w Berkeley w Kalifornii. Następnie został on wysłany do Laboratorium Metalurgicznego na Uniwersytecie w Chicago w celu wyizolowania i analizy nowego pierwiastka. 11 listopada 1945 roku, po zakończeniu II wojny światowej, odkrycie zostało ujawnione przez Seaborga w audycji radiowej, do której został zaproszony jako gość naukowy. Zostało ono oficjalnie ogłoszone w następnym tygodniu.
Klasyfikacja i pozycja pierwiastka na tablicy okresowej
| Numer grupy | Nieznany |
| Period | 7 |
| Blok | f |
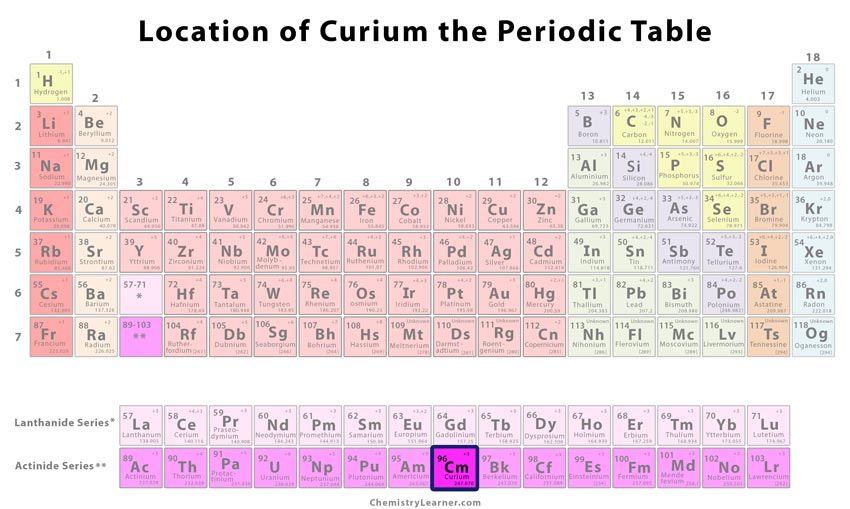
Położenie kuru w układzie okresowym
Właściwości kuru
Właściwości ogólne |
|||
| Relatywna masa atomowa | 247 | ||
| Masa atomowa | 247 atomowych jednostek masy | ||
Właściwości fizyczne |
|||
| Kolor/widok | Srebrzysta biel | ||
| Lustość | Nieznana | ||
| Odór | Nieznany | ||
| Punkt topnienia/punkt zamarzania | 1345 °C (2453°F) | ||
| Punkt wrzenia | Nieznany | ||
| Gęstość | 13.51 g/cm3 | ||
| Stan skupienia w temperaturze pokojowej (ciało stałe/ciecz/gaz) | Ciało stałe | ||
| Twardość | Nieznana | ||
| Przewodnictwo elektryczne | Nieznana | ||
| Przewodność cieplna | Nieznana | ||
| Ciepło właściwe | Nieznana | ||
Właściwości chemiczne |
|||
| Palność | Nieznana | ||
| Stany utlenienia | 4 | 3 | |
Dane atomowe kuru
| Liczba atomowa | 96 | ||||||
| Elektrony walencyjne | 2 | ||||||
| Liczba kwantowa | |||||||
| -. n | 5 | ||||||
| – ℓ | 3 | ||||||
| – m ℓ | -.3 | ||||||
| – m s | -.1/2 | ||||||
| Konfiguracja elektronowa (konfiguracja gazu szlachetnego) | 5f76d17s2 | ||||||
| Struktura atomu | |||||||
| – Liczba elektronów | 99 | ||||||
| – Liczba neutronów | 151 | ||||||
| – Liczba protonów | 99 | ||||||
| Radius of Atom | |||||||
| – Atomic radius | 2.45 Å | ||||||
| – Promień kowalencyjny | 1.68 Å | ||||||
| Elektronegatywność | Nieznana | ||||||
| Energia jonizacji
(kJmol-.1) |
1st | 2nd | 3rd | 4th | 5th | 6th | 7th |
| 578.082 | – | – | – | – | – | – | |
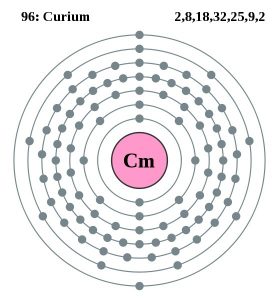
Cur Model Bohra
Do czego używa się kuru
Ponieważ nie występuje on naturalnie w skorupie ziemskiej, radioaktywny pierwiastek był wykorzystywany jedynie w podstawowych badaniach naukowych ze względu na jego ograniczoną produkcję laboratoryjną. Ponadto nie wchodzi on w reakcje z innymi związkami. Jednakże, kur-244 może mieć zastosowanie jako źródło energii do obsługi radioizotopowych generatorów termoelektrycznych stosowanych w statkach kosmicznych.
Interesting Facts About Curium
- Curium-244 został użyty w Alpha Proton X-ray Spectrometer do wykrywania obecności pierwiastków chemicznych w atmosferze i związkach powierzchni skalnej Marsa
- Uważa się, że pierwiastek ten świeci w ciemności na czerwono ze względu na swoją radioaktywną naturę
How Much Does Curium Cost
Pierwiastek radioaktywny nie jest dostępny komercyjnie poza produkcją laboratoryjną.