Generisk navn: neostigminbromid
Doseringsform: tablet
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 21. april 2020.
- Bivirkninger
- Dosering
- Professionel
- Interaktioner
- Graviditet
- Mere
Disvarsel: Dette lægemiddel er ikke blevet fundet af FDA for at være sikkert og effektivt, og denne mærkning er ikke blevet godkendt af FDA. For yderligere oplysninger om ikke-godkendte lægemidler, klik her.
Mærket Prostigmin er ophørt i USA. Hvis generiske versioner af dette produkt er blevet godkendt af FDA, kan der være generiske ækvivalenter til rådighed.
- Prostigmin Beskrivelse
- Prostigmin – Klinisk farmakologi
- Indikationer og anvendelse for Prostigmin
- Kontraindikationer
- Varsler
- Forholdsregler
- Allmentalt:
- Medicinsk interaktion:
- Carcinogenese, mutagenese og forringelse af fertiliteten:
- Graviditet:
- Sygeplejersker:
- Pædiatrisk brug:
- Bivirkninger
- Overdosering
- Prostigmin Dosering og indgift
- Hvordan leveres Prostigmin
- PRINCIPAL DISPLAY PANEL – 15 mg Label
- Mere om Prostigmin (neostigmin)
- Faglige ressourcer
- Relaterede behandlingsvejledninger
Prostigmin Beskrivelse
Prostigmin (neostigminbromid), et anticholinesterasemiddel, er tilgængeligt til oral indgivelse i 15 mg tabletter. Hver tablet indeholder også gelatine, laktose, majsstivelse, stearinsyre, sukker og talkum.
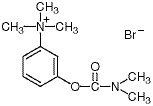
Kemisk set er neostigminbromid (m-hydroxy-phenyl)trimethylammoniumbromid dimethylcarbamat. Det er et hvidt, krystallinsk, bittert pulver, opløseligt 1:1 i vand, med en molekylvægt på 303,20 og følgende strukturformel:
Prostigmin – Klinisk farmakologi
Neostigmin hæmmer hydrolysen af acetylcholin ved at konkurrere med acetylcholin om at binde sig til acetylcholinesterase på steder med kolinerge transmission. Det forstærker den kolinerge virkning ved at lette transmissionen af impulser over neuromuskulære krydsninger. Det har også en direkte kolinomimetisk virkning på skeletmuskulaturen og muligvis på autonome ganglieceller og neuroner i centralnervesystemet. Neostigmin undergår hydrolyse af kolinesterase og metaboliseres også af mikrosomale enzymer i leveren. Proteinbindingen til humant serumalbumin varierer fra 15 til 25 %.
Neostigminbromid absorberes dårligt fra mave-tarmkanalen efter oral indgift. Som regel svarer 15 mg neostigminbromid oralt til 0,5 mg neostigminmethylsulfat parenteralt på grund af den dårlige absorption af tabletten fra tarmkanalen. I en undersøgelse hos fastende myastheniske patienter blev omfanget af absorptionen anslået til at være 1 til 2 % af den indtagne orale enkeltdosis på 30 mg. De maksimale koncentrationer i plasma opstod 1 til 2 timer efter indtagelse af lægemidlet med betydelige individuelle variationer. Halveringstiden varierede fra 42 til 60 minutter med en gennemsnitlig halveringstid på 52 minutter.
Indikationer og anvendelse for Prostigmin
Prostigmin er indiceret til symptomatisk behandling af myasthenia gravis. Den største nytteværdi er ved langvarig behandling, hvor der ikke er synkebesvær. Ved akture myasthenisk krise, hvor der er åndedræts- og synkebesvær, bør den parenterale form (neostigminmethylsulfat) anvendes. Patienten kan overgå til den orale form, så snart den kan tolereres.
Kontraindikationer
Prostigmin er kontraindiceret hos patienter med kendt overfølsomhed over for lægemidlet. På grund af tilstedeværelsen af bromidionen bør det ikke anvendes til patienter med en tidligere historie med reaktion på bromider. Det er kontraindiceret hos patienter med peritonitis eller mekanisk obstruktion af tarm- eller urinvejene.
Varsler
Prostigmin bør anvendes med forsigtighed hos patienter med epilepsi, bronchial astma, bradykardi, nylig koronarokklusion, vagotoni, hyperthyreose, hjertearytmi eller peptisk ulcus. Som regel svarer 15 mg neostigminbromid oralt til 0,5 mg neostigminmethylsulfat parenteralt, på grund af dårlig absorption af tabletten fra tarmkanalen. Store doser bør undgås i situationer, hvor der kan være en øget absorptionshastighed fra tarmkanalen. Det bør anvendes med forsigtighed ved samtidig indgift af antikolinergiske lægemidler for at undgå nedsat tarmmobilitet.
Forholdsregler
Allmentalt:
Det er vigtigt at skelne mellem myasthenisk krise og kolinergisk krise forårsaget af overdosering af Prostigmin. Begge tilstande resulterer i ekstrem muskelsvaghed, men kræver radikalt forskellig behandling. (Se afsnittet OVERDOSERING.)
Medicinsk interaktion:
Visse antibiotika, især neomycin, streptomycin og kanamycin, har en mild, men bestemt ikke-depolarisationshæmmende virkning, som kan accentuere neuromuskulær blokade. Disse antibiotika bør kun anvendes hos den myastheniske patient, hvor det er absolut indiceret, og så bør der foretages en omhyggelig justering af den supplerende anticholinesterase-dosis.
Lokal- og nogle generelle anæstetika, antiarytmiske midler og andre lægemidler, der interfererer med neuromuskulær transmission, bør anvendes med forsigtighed, hvis overhovedet, hos patienter med myasthenia gravis; dosis af Prostigmin skal muligvis øges i overensstemmelse hermed.
Carcinogenese, mutagenese og forringelse af fertiliteten:
Der er ikke foretaget undersøgelser med Prostigmin, som ville muliggøre en vurdering af dets carcinogene eller mutagene potentiale. Der er ikke foretaget undersøgelser af Prostigmins virkning på fertilitet og reproduktion.
Graviditet:
Teratogene virkninger: Graviditetskategori C
Der findes ingen tilstrækkelige eller velkontrollerede undersøgelser af Prostigmin i hverken forsøgsdyr eller hos gravide kvinder. Det vides ikke, om Prostigmin kan forårsage fosterskader, når det indgives til en gravid kvinde, eller om det kan påvirke reproduktionsevnen. Prostigmin bør kun gives til en gravid kvinde, hvis det er klart nødvendigt.
Ikke-teratogene virkninger:
Anticholinesterase lægemidler kan forårsage uterin irritabilitet og fremkalde for tidlig fødsel, når de gives intravenøst til gravide kvinder tæt på terminen.
Sygeplejersker:
Det vides ikke, om Prostigmin udskilles i modermælk. Da mange lægemidler udskilles i modermælk og på grund af muligheden for alvorlige bivirkninger af Prostigmin hos ammende spædbørn, bør der tages stilling til, om amningen skal afbrydes eller om lægemidlet skal seponeres, idet der tages hensyn til lægemidlets betydning for moderen.
Pædiatrisk brug:
Sikkerheden og effektiviteten hos børn er ikke blevet fastlagt.
Bivirkninger
Bivirkninger skyldes generelt en overdrivelse af farmakologiske virkninger, hvoraf spytdannelse og fasciculation er de mest almindelige. Tarmkramper og diarré kan også forekomme.
Der er rapporteret følgende yderligere bivirkninger efter brug af enten neostigminbromid eller neostigminmethylsulfat:
Allergisk: Allergiske: Allergiske reaktioner og anafylaksi.
Neurologiske: Svimmelhed, kramper, bevidsthedstab, døsighed, hovedpine, dysartri, miosis og synsforandringer.
Kardiovaskulær: Der er rapporteret om hjerterytmeforstyrrelser (herunder bradykardi, takykardi, A-V blok og nodalrytme) og uspecifikke EKG-forandringer samt hjertestop, synkope og hypotension. Disse er overvejende blevet noteret efter brug af den injicerbare form af Prostigmin.
Respiratorisk: Øget oral, pharyngeal og brochial sekretion og dyspnøe. Respirationsdepression, respirationsstop og bronkospasme er blevet rapporteret efter brug af den injicerbare form af Prostigmin.
Dermatologisk: Udslæt og urticaria.
Gastrointestinal: Kvalme, opkast, flatulens og øget peristaltik.
Genitourinærvæsen:
Muskuloskeletalt: Urinfrekvens.
Muskuloskeletalt:
Muskuloskeletale: Muskelkramper og -spasmer, arthralgi.
Diverse:
Overdosering
Overdosering af Prostigmin kan forårsage kolinerge kriser, som er karakteriseret ved tiltagende muskelsvaghed og gennem inddragelse af respirationsmusklerne kan medføre døden. Myasthenisk krise, som skyldes en forøgelse af sygdommens sværhedsgrad, er også ledsaget af ekstrem muskelsvaghed og kan være vanskelig at skelne fra kolinergisk krise på symptomatisk basis. En sådan differentiering er imidlertid ekstremt vigtig, fordi en forøgelse af dosis af Prostigmin eller andre lægemidler i denne klasse i tilstedeværelse af kolinerge kriser eller af en refraktær eller “ufølsom” tilstand kan have alvorlige konsekvenser. De to typer kriser kan differentieres ved brug af Tensilon® (edrophoniumchlorid) samt ved klinisk vurdering.
Behandlingen af de to tilstande adskiller sig radikalt. Mens tilstedeværelsen af myasthenisk krise kræver en mere intensiv anticholinesterasebehandling, kræver kolinerge kriser en øjeblikkelig tilbagetrækning af alle lægemidler af denne type. Det anbefales også, at der straks anvendes atropin ved kolinerge kriser.
Atropin kan også anvendes til at ophæve eller minimere gastrointestinale bivirkninger eller andre muskarinreaktioner; men en sådan anvendelse kan ved at maskere tegn på overdosering føre til utilsigtet induktion af kolinerge kriser.
Den LD50 af neostigminmethylsulfat hos mus er 0,3±0,02 mg/kg intravenøst, 0,54±0,02 mg/kg intravenøst, 0,54±0.03 mg/kg subkutant og 0,395±0,025 mg/kg intramuskulært; hos rotter er LD50 0,315±0,019 mg/kg intravenøst, 0,445±0,032 mg/kg subkutant og 0,423±0,032 mg/kg intramuskulært.
Prostigmin Dosering og indgift
Det indsættende virkningsmoment for Prostigmin givet oralt er langsommere end når det gives parenteralt, men virkningsvarigheden er længere og virkningsintensiteten mere ensartet. Doseringskravene for optimale resultater varierer fra 15 mg til 375 mg pr. dag. I nogle tilfælde kan det være nødvendigt at overskride disse doser, men man skal være opmærksom på muligheden for en kolinerge krise. Den gennemsnitlige dosis er 10 tabletter (150 mg), der indgives over en 24-timers periode. Intervallet mellem doserne er af afgørende betydning. Doseringsskemaet bør justeres for hver enkelt patient og ændres, når behovet opstår. Ofte er det nødvendigt med behandling dag og nat. Større portioner af den samlede daglige dosis kan gives på tidspunkter, hvor patienten er mere tilbøjelig til at blive træt (om eftermiddagen, ved måltider osv.). Patienten bør opfordres til at føre en daglig journal over sin tilstand for at hjælpe lægen med at fastlægge et optimalt behandlingsregime.
Hvordan leveres Prostigmin
Graverede, hvide tabletter indeholdende 15 mg neostigminbromid-flasker med 100 stk. (NDC 0187-3100-10). Påtryk på tabletter: (forside) Prostigmin 15; (bagside) V.
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
(949) 461-6000
Rev. 02/08
PRINCIPAL DISPLAY PANEL – 15 mg Label
NDC 0187-3100-10
Rx Only
Prostigmin®
(neostigminbromid)
15 mg
100 tabletter
Hver tablet indeholder 15 mg neostigminbromid
VALEANT™

| Prostigmin neostigminbromid tablet |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Mærkningssted – Valeant Pharmaceuticals North America LLC (042230623)
Mere om Prostigmin (neostigmin)
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- Lægemiddelklasse: kolinerge muskelstimulerende midler
Faglige ressourcer
- Oplysningsinformation
- Neostigminmethylsulfat-injektion (FDA)
Andre mærker Bloxiverz
Relaterede behandlingsvejledninger
- Myasthenia Gravis
- Urinretention
Medicinsk ansvarsfraskrivelse